闻乐 发自 凹非寺
量子位 | 公众号 QbitAI
什么?原以为高考后脑子就不灵了,但其实四十岁之前都是当打之年!

一项发表于《美国国家科学院院刊》(PNAS)的研究,揭开了大脑衰老的神秘面纱,还找到了对抗衰老的关键时间窗口和干预方法。
科学家分析了超1.9万人功能性磁共振成像(fMRI),发现大脑衰老并不是慢慢发生的,而是遵循特定的非线性进程,并且与胰岛素抵抗增加相关。
此外,研究还发现酮体作为一种可绕过胰岛素抵抗为神经元供能的物质,对稳定大脑有显著作用。
并且,酮体在40-59岁干预效果最佳。

也就是说,新脑子还能安心用几年,中年再抗衰也不迟(doge
来看看具体研究过程。
大脑衰老呈非线性特征,胰岛素抵抗是关键
传统观念可能认为大脑衰老是一个匀速、线性的过程。
该研究通过对人类连接组计划衰老队列(HCP-A)、英国生物银行(UKB)、加州大学伯克利分校人类衰老队列(BU)和荷兰生命周期研究(LCS)这四个大规模数据集(共19300名参与者)的功能性磁共振成像(fMRI)分析,发现大脑网络随年龄的变化呈现出非线性(S形)的特点。
以HCP-A数据集为例,S形模型比线性趋势更能精准拟合数据,更精准地描述大脑网络不稳定程度随年龄的变化情况。

S形模型呈现出一种先缓慢变化、然后加速变化、最后又趋于平稳的趋势,这与大脑衰老的实际过程更为相符。
具体来说,在生命的早期阶段,大脑具有较强的可塑性和代偿能力,因此大脑网络的不稳定程度变化较为缓慢。
随着年龄的增长,接近中年时(约43.7岁,即模型中的α年龄点),大脑网络的不稳定程度开始加速上升。
而最快不稳定年龄约为66.7岁(即模型中的I年龄点),在这个年龄附近,大脑衰老的速度达到最快,之后会逐渐进入一个相对稳定的平台期。
研究人员为确定大脑衰老的原因,对参与者的代谢、血管和炎症等相关生物标志物在大脑衰老非线性转变点的变化进行了分析,同时结合了大脑衰老区域异质性与基因表达的关系进行探究。
结果显示,神经元胰岛素抵抗是大脑衰老轨迹的驱动机制。
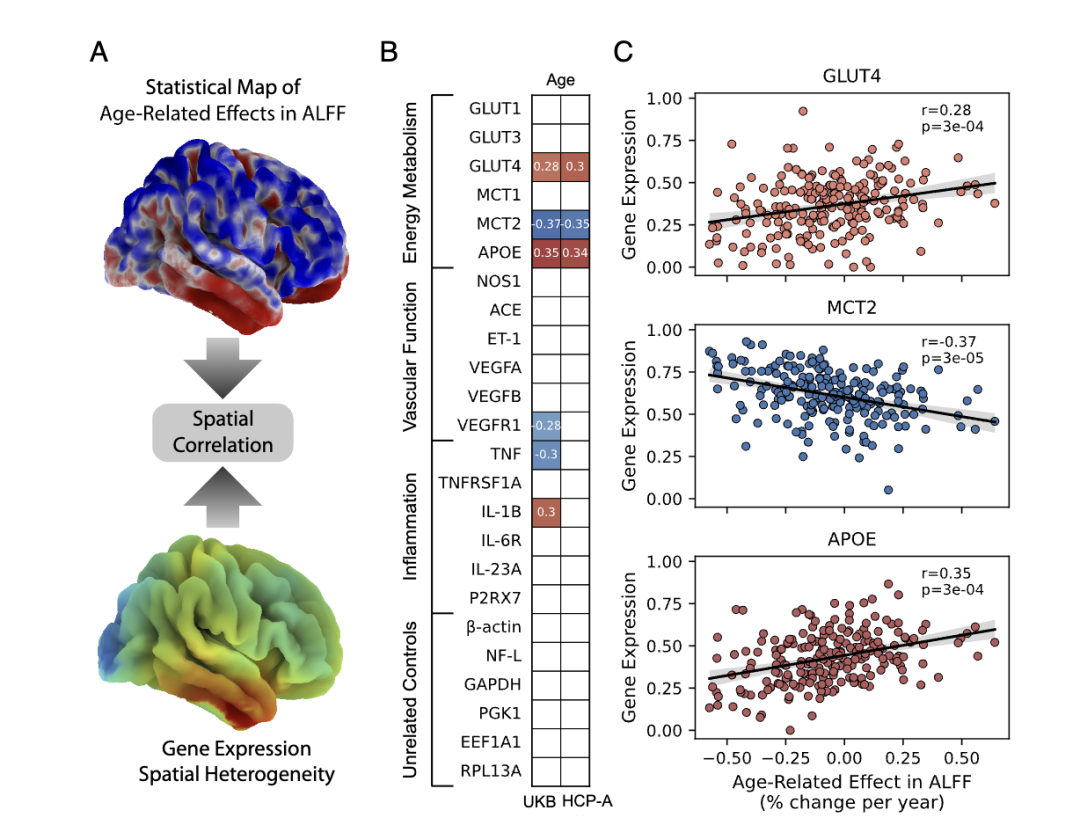
胰岛素的正常功能是帮助将葡萄糖从血液转运到细胞内以供能,而胰岛素抵抗时,细胞对胰岛素不敏感,葡萄糖难以进入细胞,导致其在血液中停留时间延长,血糖升高。
大脑作为对胰岛素敏感且依赖葡萄糖供能的器官,也会受到胰岛素抵抗的影响。
当发生胰岛素抵抗时,神经元的能量供应和能量代谢会失调,从而进一步影响大脑网络的稳定性。
胰岛素依赖性葡萄糖转运蛋白GLUT4和脂质转运蛋白APOE与衰老相关,胰岛素抵抗会影响这些与葡萄糖转运等相关基因的正常功能,使神经元无法正常获取葡萄糖。
这意味着大脑衰老可能源于葡萄糖代谢的异常,而胰岛素抵抗在其中起到关键作用。
酮体干预是有效抗衰方式
胰岛素抵抗是大脑衰老的关键驱动因素,它导致神经元葡萄糖代谢异常,影响大脑正常功能。
而酮体(如D-β-羟基丁酸,D-βHB)能绕过胰岛素抵抗,为神经元提供替代能量来源,这使得酮体干预成为对抗大脑衰老的潜在有效方式。
为了验证这一猜想,研究团队对101名年龄在21-79岁的健康成年人进行了酮体干预的自身对照实验。
让每位参与者分别接受外源性酮体(D-βHB)和热量匹配的葡萄糖干预,且两次干预在不同时间进行,以排除其他因素干扰。
参与者隔夜禁食后先进行首次MRI(磁共振成像)扫描建立基线,给药30分钟后再次扫描,此时D-βHB和葡萄糖在大脑中达稳定浓度,便于检测对大脑网络稳定性的影响。
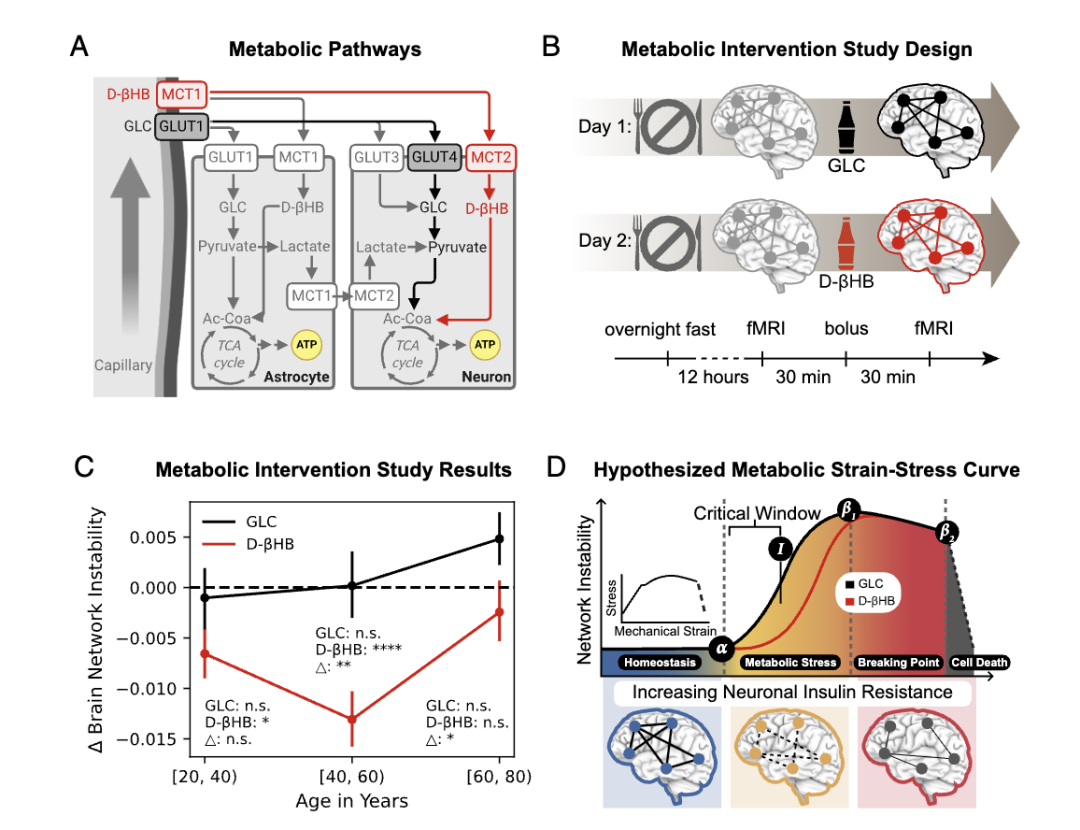
实验中,与D-βHB热量匹配的葡萄糖在所有年龄组均未显示出稳定大脑网络的显著效果。
这表明D-βHB稳定大脑网络的效果并不是由热量摄入引起的,而是通过非GLUT4(即非胰岛素)介导的途径实现的,突出了酮体干预效果的特异性。
在C图中可看出,对20-39岁年龄组,D-βHB与禁食状态相比,显著稳定了大脑网络。
在40-59岁年龄组,即大脑网络开始快速不稳定的阶段,D-βHB的效果更为突出,其稳定大脑网络的效果比20-39岁组大84.62%。
然而,对于60-79岁年龄组(I年龄组),D-βHB稳定大脑网络的效果明显减弱,效果不到20-39岁组的一半。
这说明酮体干预在中年阶段(40-59岁)对稳定大脑网络的效果最佳。
也就是说,中年是大脑衰老 “转折点”,也是干预黄金期!
感兴趣的朋友可查看原文获取更多细节~
原文链接:https://www.pnas.org/doi/10.1073/pnas.2416433122
— 完 —
📪 量子位AI主题策划正在征集中!欢迎参与专题365行AI落地方案,一千零一个AI应用,或与我们分享你在寻找的AI产品,或发现的AI新动向。
💬 也欢迎你加入量子位每日AI交流群,一起来畅聊AI吧~

一键关注 👇 点亮星标
一键三连「点赞」「转发」「小心心」
欢迎在评论区留下你的想法!
(文:量子位)

