不圆 发自 凹非寺
量子位 | 公众号 QbitAI
治愈不治之症,又被向前推进了一公里:直接修改基因的那种。
发表在《PLOS Biology》(生物学top期刊)的最新研究显示,荷兰科学家成功纠正了线粒体DNA中的突变,在基因治疗领域取得重大突破。

我们知道,线粒体基因突变会导致其功能障碍,进而引发与衰老相关的疾病、某些类型的癌症以及严重且可能致命的母系遗传线粒体疾病。
尽管CRISPR/Cas技术的开发为核DNA编码的突变带来了革命性的可能性,但该系统无法有效穿过线粒体膜并到达线粒体DNA,导致患有线粒体疾病的患者没有治疗的选择。
而DdCBE(双链DNA脱氨酶衍生的胞嘧啶碱基编辑器)解决了这个问题,能够通过一种不依赖CRISPR/Cas的系统在线粒体基因组中进行编辑,精确改变线粒体DNA中的错误遗传字母,无需切割DNA链。
该研究让一些饱受疾病困扰的网友看到了治愈的希望。
在原代成人细胞中有效恢复线粒体功能
为探索DdCBE介导的线粒体DNA基因编辑的临床应用潜力,论文的研究团队在相关细胞类型中构建并功能校正了致病突变。
通过在人类成体肝脏类器官中引入致病性m.15150G>A突变,观察到其对ATP生成的显著影响;在Gitelman样综合征患者来源的成纤维细胞中成功校正m.4291T>C突变,可改善线粒体功能。
为推进DdCBE的临床转化,研究团队采用目前最先进的非病毒基因递送系统——脂质纳米颗粒(LNPs)实现了修饰RNA(modRNA)编码的线粒体碱基编辑器高效递送。
该研究证实,DdCBE能在原代成人细胞中有效恢复线粒体功能。
在患者来源的类器官中构建m.15150G>A突变
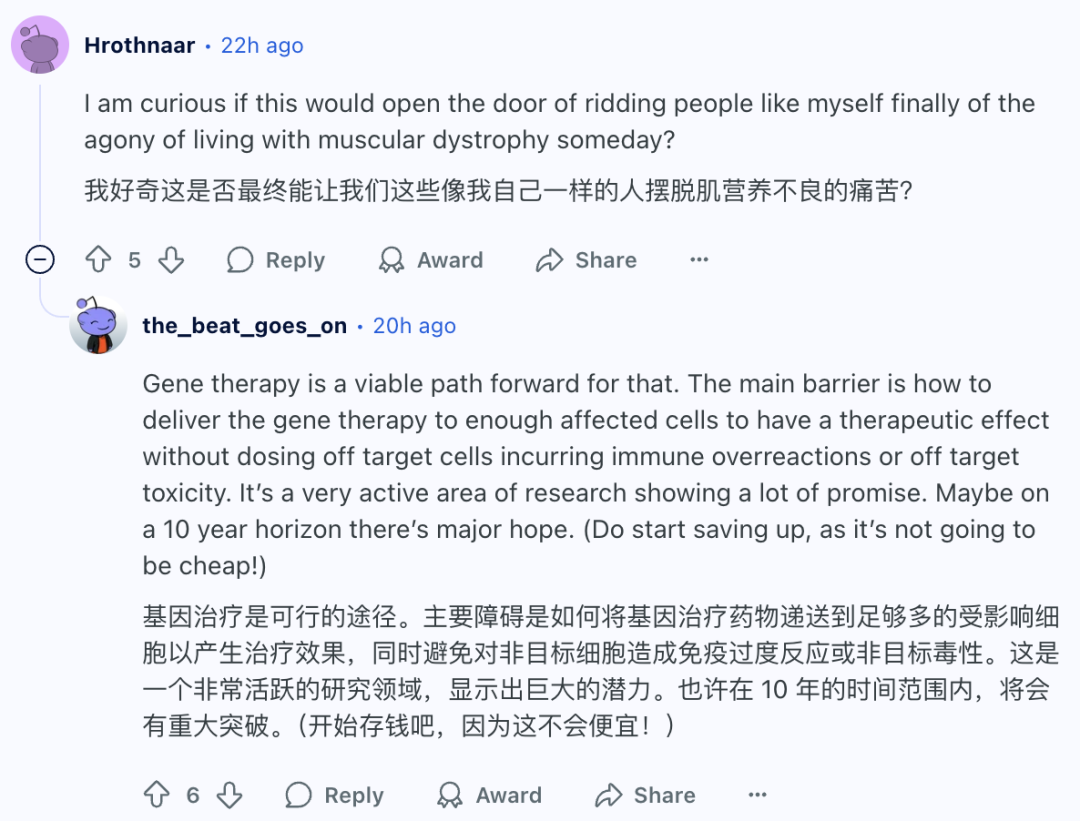
在人类原代成人体肝干细胞来源的类器官中引入致病性线粒体突变,以MT-CYB基因中的m.15150G>A突变为例,这个无义突变可能会完全丧失细胞色素B蛋白的功能。
为了精确靶向DdCBE至m.15150G,研究团队设计了两组左端和右端TALEs,如下图。
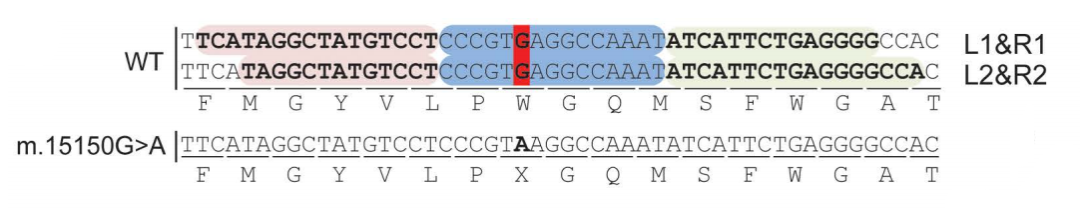
在HEK293T细胞中对所有四种左/右构建组合的验证表明,每种组合在m.15150处的G→A编辑效率都很高。
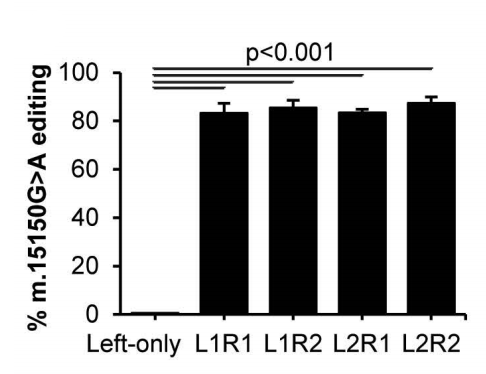
编辑特异性由靶向编辑与旁观者编辑的比率定义,结果表明使用R2构建组合的比率更高。
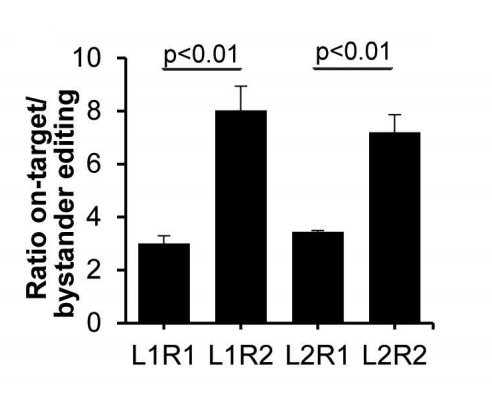
这些结果表明L1R2和L2R2是最佳组合,尽管效率更高的m.15150G>A无义突变可能掩盖了下游旁观者编辑的任何功能效应,因为m.15154C>T是一个沉默突变,而m.15155C>T是另一个无义突变。
出于一致性和旁观者编辑可能效果较差的原因,研究团队在进一步分析中继续使用L1R1。
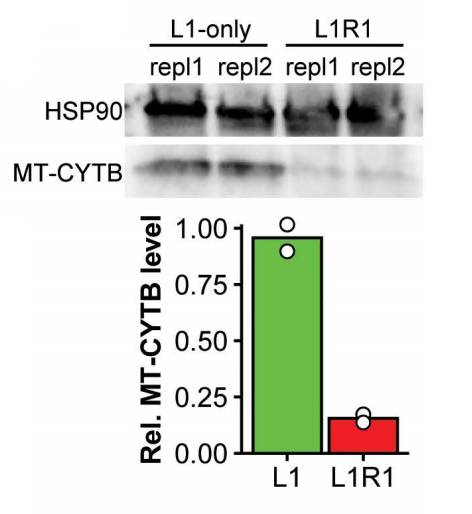
用L1R1编辑的HEK293T细胞中进行细胞色素B的Western blot,结果显示细胞色素B蛋白水平降低。
随后,研究团队建立了一种通过电穿孔和FACS(流式细胞分选)共转染GFP来选择转染的类器官细胞的线粒体编辑方案。
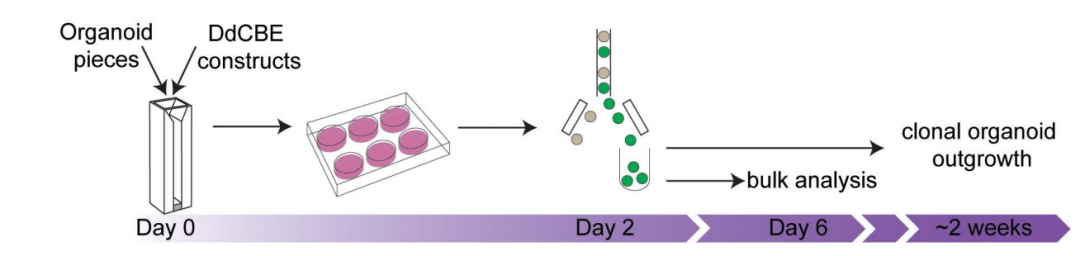
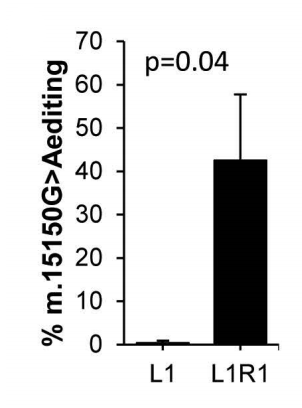
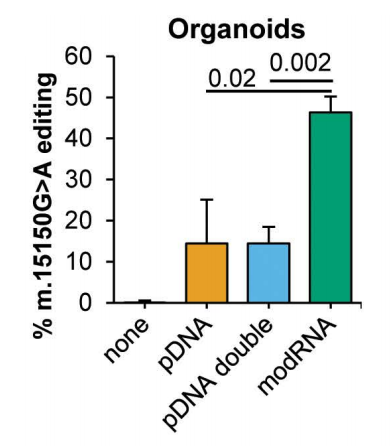
将电穿孔设备应用于类器官后,m.15150G>A的平均编辑效率为43%。
由于每个细胞含有数百到数千个mtDNA分子,因此编辑效率可能在单个细胞之间有显著差异。为了解决这个问题,研究团队采用单细胞方法来阐明DdCBE效率的内在变异性。
对单次FACS分选的类器官细胞衍生的克隆类器官进行测序显示,编辑效率范围在0%到80%。
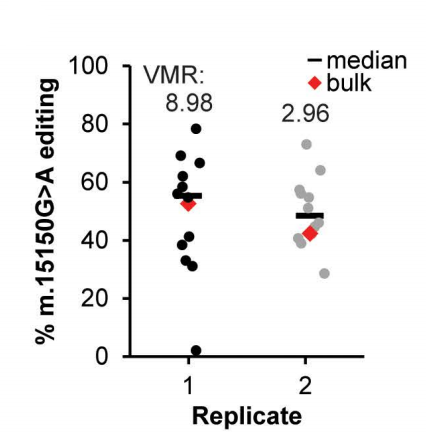
两次实验的平均变异系数(VMR)为5.96,表明存在相对较高的离散度。
这些结果表明,DdCBE和类器官系的克隆生长可能是研究异质性对疾病机制影响的有用工具。
在患者来源的成纤维细胞中校正m.4291T>C突变
为了研究在原代细胞中纠正线粒体突变是否能恢复线粒体活性,研究团队选择了m.4291T>C突变。
该变异位于编码线粒体异亮氨酸tRNA的MT-TI基因中,并影响反密码子上游高度保守的尿嘧啶。
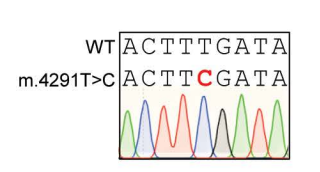
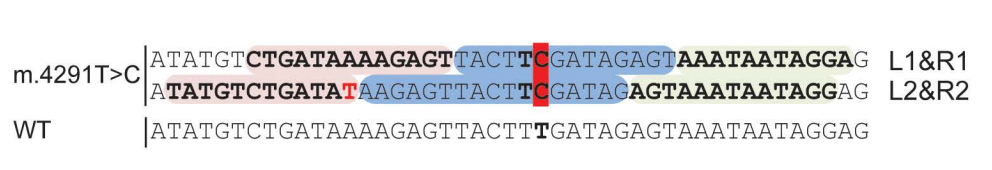
同样的,研究团队设计了两组左、右TALEs来引导DdCBE至m.4291C,并在L2中引入一个不匹配但优选的胸腺嘧啶末端重复可变二肽(RVD)。
用器官样电穿孔方案处理成纤维细胞,并在FACS后以批量或单细胞方式接种细胞。
在同质化人类皮肤成纤维细胞上测试四种DNA构建体组合后发现,L2R2组合是恢复MT-TI突变的最高效编辑器。
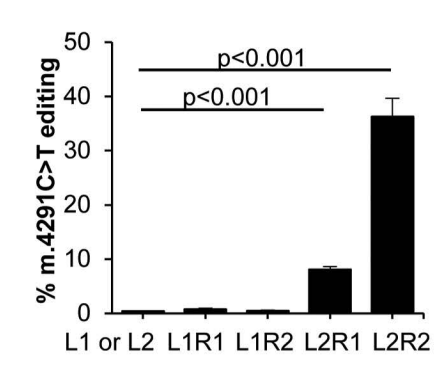
为了比较单个成纤维细胞之间的基因校正效率,研究团队从单个转染的成纤维细胞中衍生出克隆系,揭示了单个成纤维细胞之间编辑效率的显著差异。
与肝类器官类似,皮肤成纤维细胞的编辑效率离散度相当大(平均VMR:6.8)。
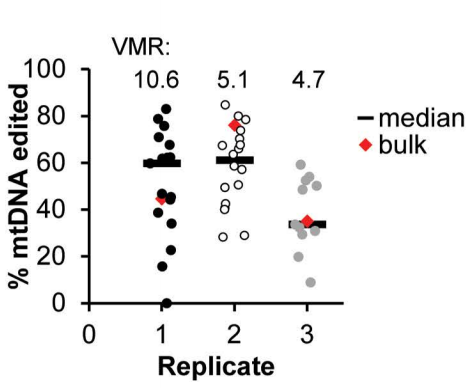
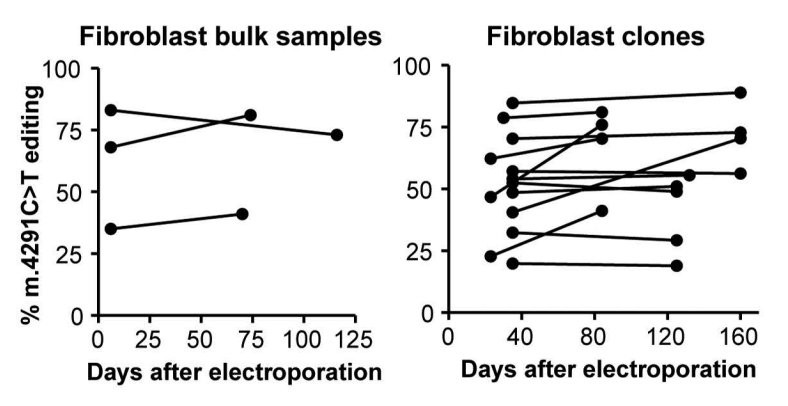
为了评估编辑后的mtDNA在细胞mtDNA库中的稳定性,研究团队在培养超过50天后对编辑后的成纤维细胞(包括克隆和大量细胞系)进行测序。
有趣的是,在大多数成纤维细胞系中,m.4291T编辑的分数随时间增加,这反映了编辑后的mtDNA没有选择劣势。
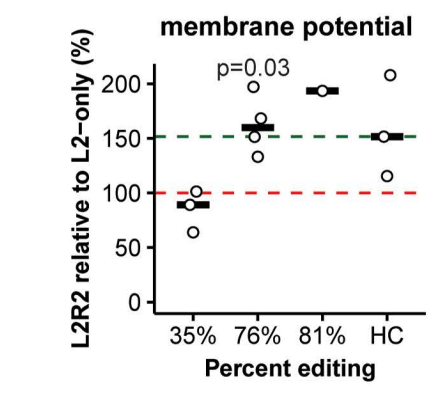
另外,线粒体tRNA基因(如MT-TI)的突变已被报道会降低线粒体膜电位。因此,纠正m.4291T>C突变有望提高患者来源成纤维细胞的膜电位。
研究团队使用图像流式细胞术,分析了该突变在异质性水平背景下的功能效应。
TMRM染色检测显示,在突变校正率达76%和81%的成纤维细胞中,线粒体膜电位确实得到改善;而校正率仅为35%的细胞则未观察到这一效应。
为进一步探究基因校正后线粒体的功能变化,研究团队采用Seahorse能量代谢分析系统进行检测。
结果显示:在葡萄糖培养基中,校正后的成纤维细胞表现出基础耗氧率(OCR)和ATP生成的适度提升;但在强制细胞依赖线粒体呼吸的半乳糖培养基中,这种改善并未出现。
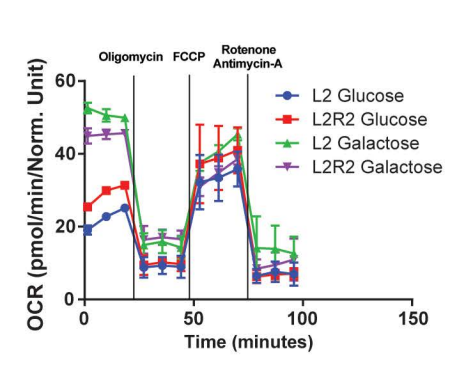
然而,这些功能改善在不同实验批次间未能保持一致性。
尽管m.4291T>C突变的校正恢复了线粒体膜电位,但OCR的功能改善并不稳定,这表明在经校正的患者成纤维细胞中,线粒体功能恢复最多也只是适度水平。
基于modRNA和LNPs的线粒体碱基编辑
有效且安全的递送方法对于DdCBE的治疗应用至关重要。以modRNA形式包裹在LNPs中的、基于CRISPR的编辑工具,已经成功应用于多种体内模型。
为此,研究团队将靶向m.15150G和m.4291C的DdCBE构建体制备为modRNA,以探究LNP递送DdCBE modRNA在原代患者来源细胞中编辑mtDNA的潜力。
研究modRNA在类器官中用于m.15150G>A编辑的效果,与GFP构建体共转染显示,modRNA的转染效率比DNA质粒高17倍。
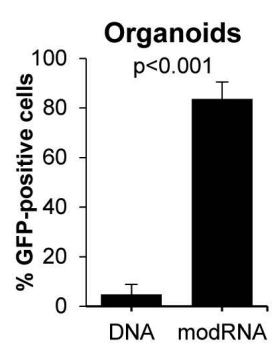
即使在通过GFP-FACS筛选转染细胞后,转染后第6天,modRNA转染类器官的mtBE效率在常规或双倍剂量下仍比DNA转染类器官高约4倍(图3B)。
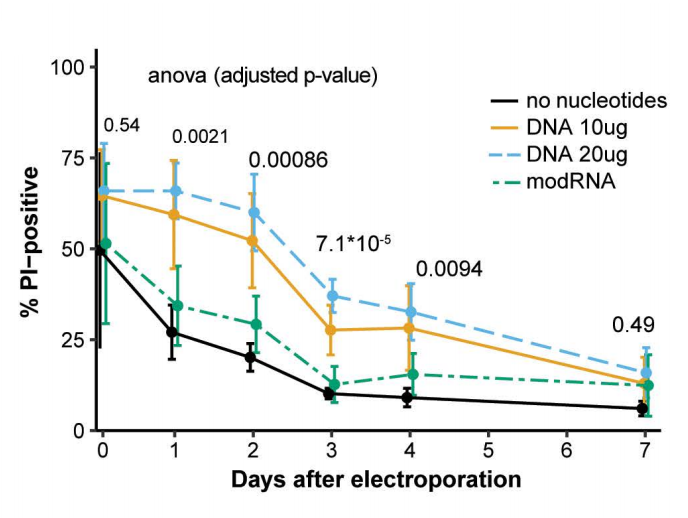
为研究使用modRNA对细胞死亡的影响,研究团队通过电穿孔在DNA和RNA转染后监测细胞7天。
结果显示,DNA转染导致类器官的细胞死亡比modRNA转染或无核苷酸对照至少高3倍,持续至少4天。
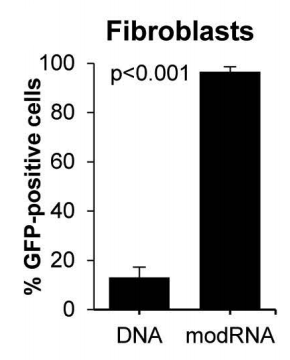
研究团队还研究了modRNA在患者来源成纤维细胞中的校正效果,结果表明,转染效率从DNA的13.1%提高到编码DdCBE蛋白和GFP的modRNA的96.6%。
使用modRNA时,m.4291T>C校正的平均效率为59%。
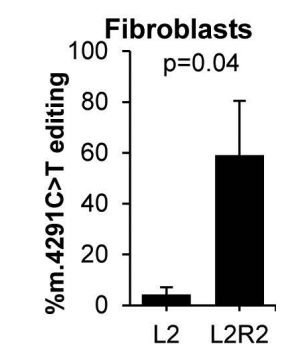
这些结果表明,modRNA作为一种体外递送工具,具有极大的潜力,能够在保持活性的同时实现高效率。这对于难以维持和转染的细胞可能特别有前景。
为验证DdCBE与LNPs递送系统的兼容性,研究团队将靶向m.4291T>C的modRNA编码DdCBE编辑系统与GFP-modRNA共同封装于LNPs中。
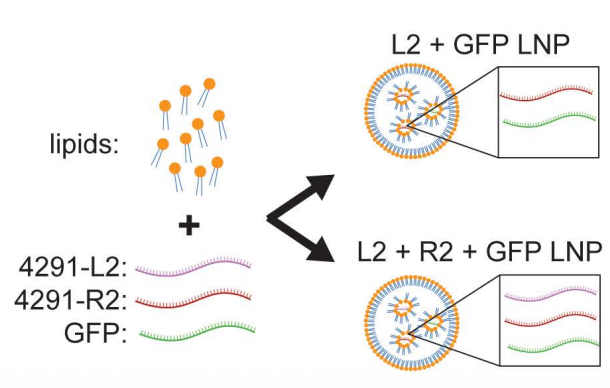
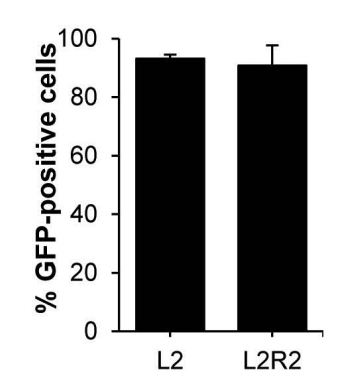
用该制剂处理m.4291T>C突变成纤维细胞3天后,流式细胞检测显示:无论是单独L2组件还是L2R2复合组件,其转染效率均超过90%。
该递送效率与商品化转染试剂介导的modRNA脂质体转染相当。
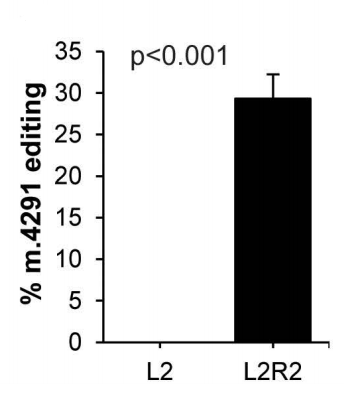
尤为关键的是,向12500个原代患者来源成纤维细胞递送1µg LNP包裹的modRNA-DdCBE,可实现平均28%的编辑效率,充分展现了该技术在治疗性基因编辑中的应用潜力。
经校正患者成纤维细胞的脱靶编辑分析
研究团队还对基因校正后的成纤维细胞进行了脱靶编辑分析。
基于L2和R2-TALE靶序列的同源性,研究团队筛选了核基因组中9个潜在的脱靶位点。通过NGS扩增子测序发现,这些位点间隔区内存在少量C•G→T•A碱基替换(最高占测序读数的0.2%)。

然而,在三组独立重复实验中,这些替换在基因编辑组中的丰度均未显著高于未校正的L2-only对照组,表明DdCBE-m.4291-L2R2碱基编辑器至少在这9个高同源性脱靶位点未产生显著编辑活性。
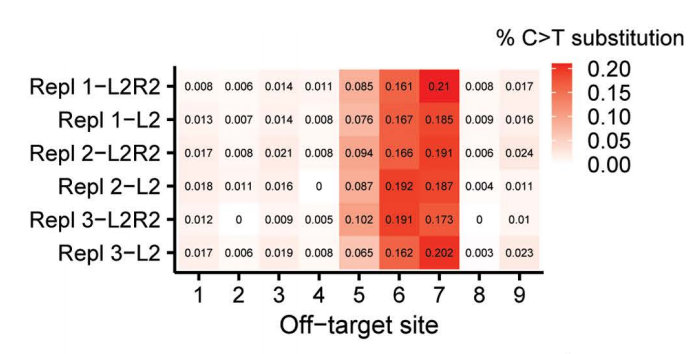
进一步在线粒体基因组靶向扩增区内(超出间隔区范围)检测发现:MT-TQ基因中的m.4333和m.4354两个位点,在至少一组L2R2重复实验中出现>1%的C•G→T•A替换(较L2-only对照组高2倍以上),提示可能存在DdCBE-m.4291-L2R2介导的近端旁观编辑。
但全基因组线粒体测序并未重复检测到这些特异性替换,暗示其可能是NGS前PCR扩增引入的假象。
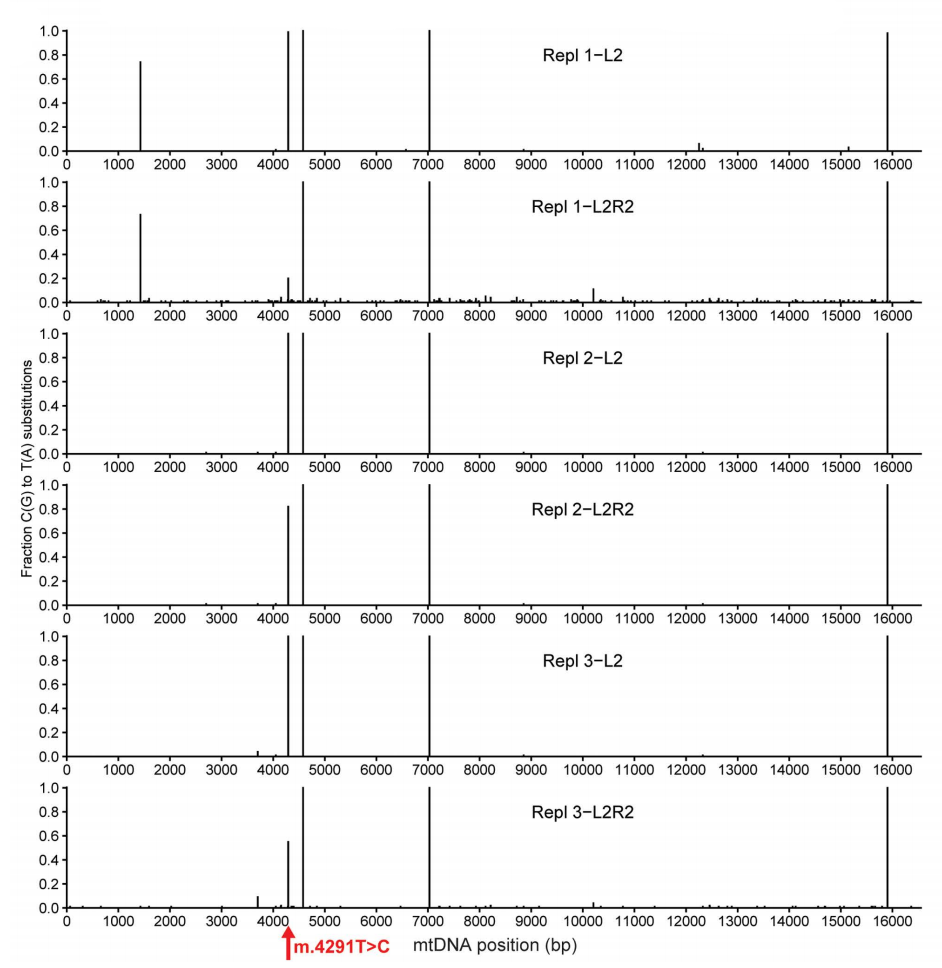
值得注意的是,研究团队在L2R2处理组其他位点观察到>1%的C•G→T•A脱靶编辑,且脱靶位点数量与靶向编辑效率呈正相关(三组重复实验的脱靶位点数分别为40、0和6个,对应81%、18%和45%的靶向编辑效率)。
综上所述,该论文的研究团队在核基因组选定的9个序列依赖性脱靶位点中未检测到脱靶编辑,而线粒体脱靶编辑似乎与靶向编辑相关,正如预期的那样,尽管样本量较小。
距离临床还有数年时间
该研究表明,在原发性患者来源的成纤维细胞和人类成体肝脏干细胞衍生的类器官中,能够高效实现线粒体DNA突变的创建与修正。
通过LNPs递送DdCBE-modRNA成功校正患者成纤维细胞的m.4291T>C突变,证明了DdCBE与modRNA-LNPs递送系统的兼容性。
虽然m.4291T>C突变的校正恢复了线粒体膜电位,但未显著提升ATP产量或氧化呼吸功能,这一发现提示需要开展更深入的线粒体碱基编辑功能研究,包括评估线粒体脱靶编辑的影响。
经过数周培养,研究未发现校正后的线粒体DNA在群体或克隆群体中出现明显丢失,表明编辑后的mtDNA保持稳定且具有功能,至少对该特定突变而言,基因编辑不会随时间推移产生选择劣势。
相反,可以观察到所有克隆中编辑mtDNA比例均呈现轻微净优势,这提示该校正方法具有长期有效性的潜力。
简言之,DdCBE是一种有前景且精确的基因编辑工具,可用于在原代患者来源细胞类型中创建和纠正线粒体突变,并且与modRNA和LNP递送具有良好的兼容性。
虽然临床应用还有数年时间,但这项研究标志着朝着治疗性编辑线粒体DNA迈出了巨大一步。
(文:量子位)

