一次CT检查,一份隐藏的癌症预警:GRAPE模型重塑早期筛查范式
-
• 核心突破:一项发表于《自然·医学》的研究展示了一款名为GRAPE的AI模型,该模型能利用临床广泛使用的非增强CT(Non-contrast CT) 影像,实现大规模胃癌机会性筛查。 -
• 性能验证:在覆盖超1.8万病例的多中心验证中,模型展现出高诊断精度(AUC达0.927),并在与13名放射科医生的对比研究中表现更优。 -
• 真实世界证据:在覆盖近8万名患者的回溯性研究中,GRAPE不仅将高风险人群的胃癌检出率提升至12%以上(其中早期病例占23%-27%),并成功在一个案例中比临床确诊提前6个月识别出病灶。 -
• 技术价值:该技术的核心在于其 “机会性筛查” 能力,有望将海量存量医疗影像数据转化为癌症早期预警的工具,重塑公共卫生筛查策略。
核心创新:解锁非增强CT的潜力,实现“机会性筛查”
胃癌(Gastric Cancer, GC)是全球主要的致死癌症之一,其防治的关键在于早期诊断。早期胃癌的5年生存率超过95%,但进展期则急剧下降。这道由时间划下的“生死线”,凸显了早期筛查的紧迫性。
然而,作为金标准的胃镜检查,因其侵入性、成本和对专业资源的依赖,在大规模人群筛查中始终步履维艰。我们能否找到一种非侵入性、低成本且高效的筛查新范式?近日,发表在国际顶尖期刊 《自然·医学》 的一项研究给出了肯定的答案。
这项研究的核心突破在于,它将目光投向了医院里最常见的影像检查之一——非增强CT。研究团队开发的GRAPE模型,旨在将这些被“忽视”的数据变为“宝藏”。其核心理念是 “机会性筛查” :在患者因任何原因接受腹部CT检查时,AI系统自动、同步地对胃癌风险进行分析。这种模式不产生额外检查成本,却能让每一次常规检查都成为一次潜在的癌症预警。
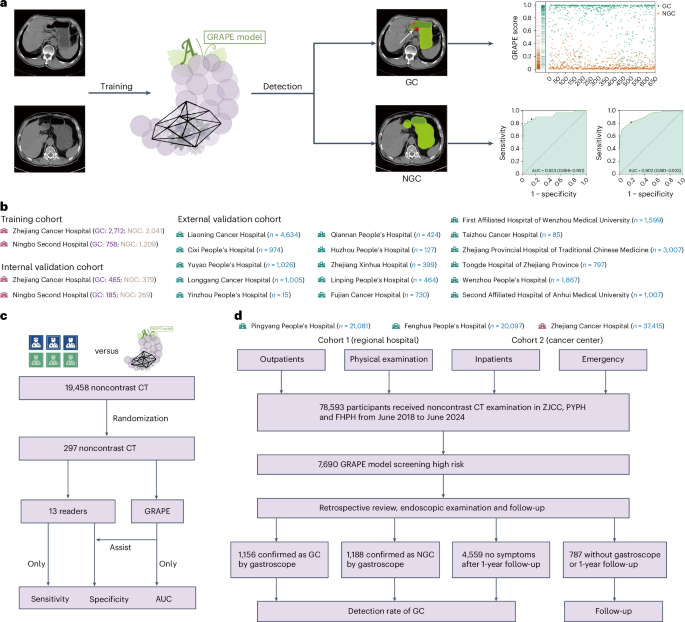
图1:GRAPE模型开发与验证概览。 该图展示了模型从开发、多中心验证,到真实世界研究的完整流程,体现了其从理论到实践的全链条设计。
AI技术解析:GRAPE如何实现高精度诊断
GRAPE的强大性能,源于其精巧的AI架构——一个两阶段、联合分类与分割的深度学习框架。
1. 两阶段架构:从定位到诊断
模型首先采用基于nnUNet的分割网络,如同精准的GPS,在整个3D腹部CT容积中自动识别并“裁剪”出胃部区域(ROI)。这一步至关重要,它能排除周围组织的干扰,让后续分析更具针对性和效率。
2. 联合学习:兼顾“是什么”与“在哪里”
裁剪出的胃部区域被送入一个双分支网络,协同工作:
-
• 分割分支 (Segmentation Branch):扮演“现场勘查员”,以像素级的精度勾勒出可疑肿瘤的边界。 -
• 分类分支 (Classification Branch):则像“首席分析师”,综合所有深层特征,输出一个最终的概率评分,判断患癌风险。
这种分类与分割联合学习的机制,不仅能回答“有没有风险”,还能直观地指出“风险在哪里”,为临床医生提供了可解释、可信赖的诊断依据。正如论文的 扩展数据附图1 (Extended Data Fig. 1) 所示,通过Grad-CAM技术生成的热力图,清晰地显示了AI的“注意力”与真实肿瘤位置高度重合,有力地驳斥了“AI黑箱”的疑虑。
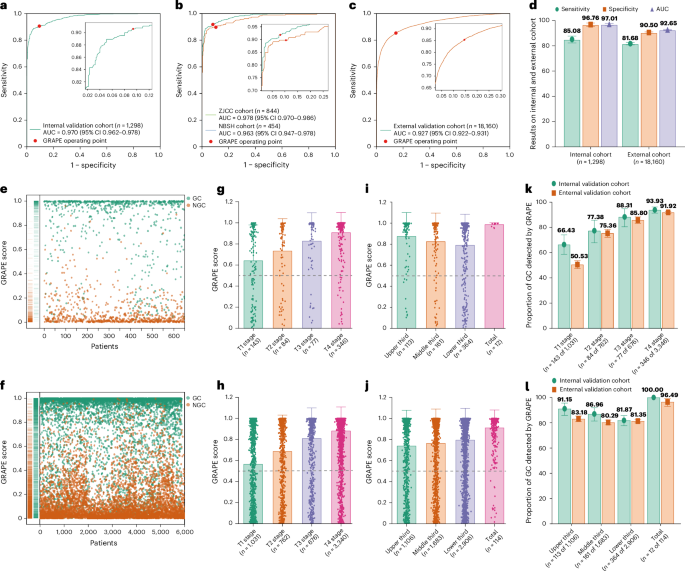
图2:GRAPE的性能评估。 ROC曲线显示,模型在内部验证集(a)和外部验证集(c)中均表现出优异的诊断性能(AUC分别为0.970和0.927)。同时,其对不同分期(k)和位置(l)的肿瘤均有稳定的检出能力。
性能验证:数据驱动的客观评估
为检验GRAPE的真实能力,研究团队进行了多维度、大规模的验证。
-
• 多中心泛化能力:在包含16个中心的18,160例数据的独立外部验证中,GRAPE的AUC达到了0.927。扩展数据附图2 (Extended Data Fig. 2) 进一步证实了其强大的泛化能力,在各个独立中心均保持了高水平性能(AUC范围0.902-0.995)。 -
• 与人类专家对比:在一项涉及297份CT影像的读片研究中,GRAPE的表现(AUC 0.92)显著优于13位不同经验水平的放射科医生(AUC 0.76-0.85)。即使在AI辅助下,人类医生的平均表现也未能超越AI的独立判断水平。 -
• 实用性洞察:扩展数据附图3 (Extended Data Fig. 3)揭示了一个重要的临床细节:在胃部填充良好的情况下,GRAPE对早期胃癌(EGC)的检出敏感性比填充不佳时高出10.72%,为未来优化筛查流程提供了直接依据。
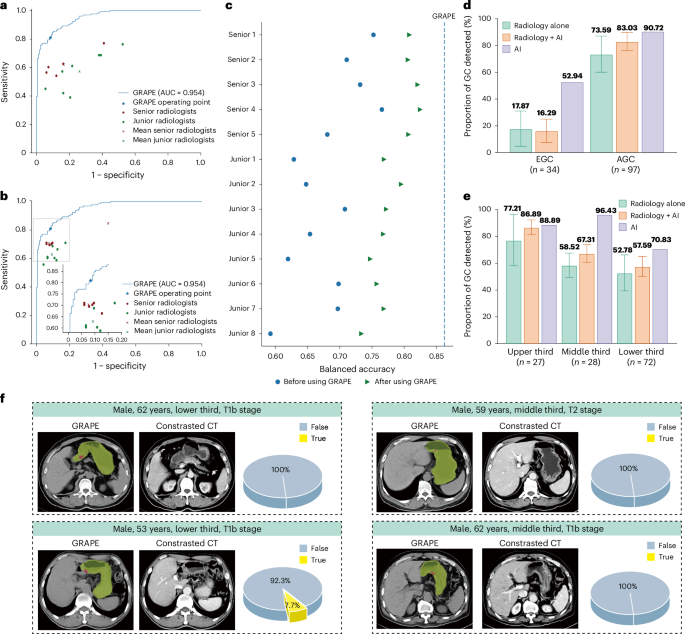
图3:读片研究对比结果。 该图直观对比了GRAPE(AI)、放射科医生独立诊断、以及AI辅助下医生诊断的性能。结果显示,GRAPE在准确性、敏感性和特异性上均有明显优势。
真实世界研究:临床价值的最终证明
模型最终的价值,在于它能否在真实的临床洪流中掀起波澜。研究团队对来自三家医院的78,593名患者的历史CT数据进行了大规模回溯性分析,结果令人振奋。
-
• 高检出率与早期发现:GRAPE识别出的高风险人群中,经后续确认的胃癌检出率达到了12.1%至24.49%。更重要的是,基于扩展数据表4 (Extended Data Table 4)的分析显示,这些病例中T1/T2期早期胃癌的比例分别达到了23.2%和26.8%,证明了该技术在发现可治愈阶段癌症方面的巨大价值。 -
• 提前预警的力量:研究中最具震撼力的发现,莫过于GRAPE的超前预警能力。在一个典型案例中,一名患者因肺部疾病定期随访CT,报告从未提示胃部异常。然而,当GRAPE回溯分析他6个月前的CT影像时,已成功识别出高风险病灶。而当这位患者在6个月后因腹部不适最终确诊时,癌症已进展至T4a期。这被AI“追回”的6个月,对一个生命而言,其分量不言而喻。
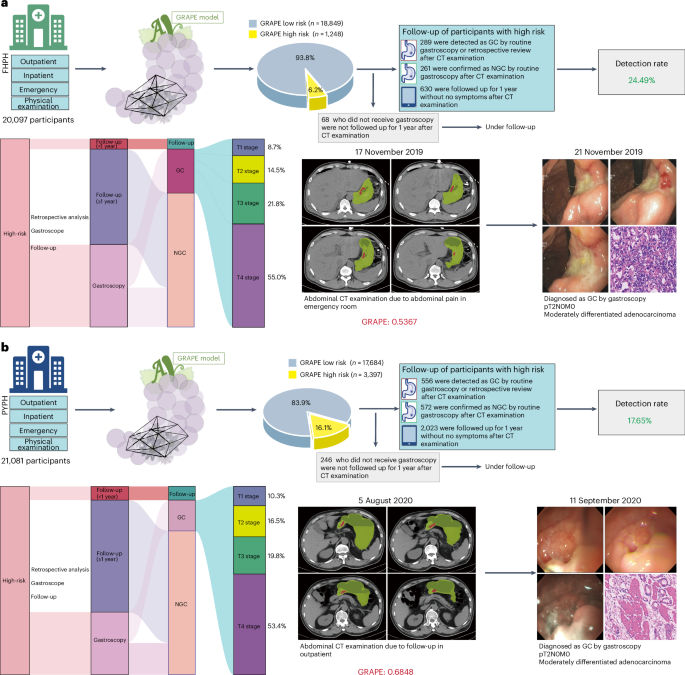
图4:真实世界筛查流程与案例(地区医院)。 展示了GRAPE在两家地区医院对超过4万名患者进行机会性筛查的流程,并识别出大量高风险病例。
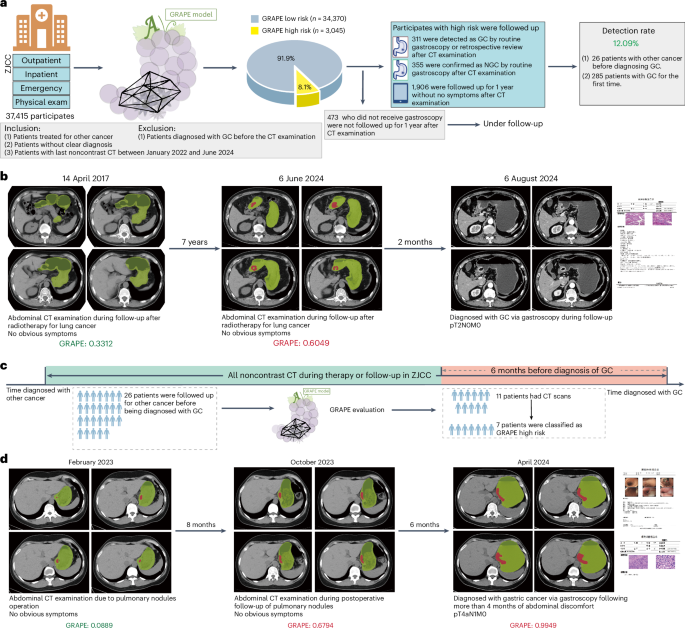
图5:真实世界筛查流程与案例(癌症中心)。 展示了GRAPE在癌症中心的应用,并提供了一个成功提前6个月发现胃癌的实例,证明了其超早期诊断的潜力。
临床意义与未来展望
GRAPE模型的成功验证,对未来癌症筛查和AI医疗具有深远意义。
-
• 范式转变:它将癌症筛查从“主动专项检查”向“被动机会性发现”转变,能以极低的边际成本,极大化利用现有医疗数据,是实现大规模、经济高效的公共卫生干预的有效途径。 -
• 临床工作流优化:未来,AI可作为第一道防线,对所有腹部CT进行自动初筛,将高风险病例推送给医生复核,从而优化医疗资源分配,提升诊断效率。 -
• 技术可扩展性:该技术框架具备扩展潜力,未来可被训练用于检测胰腺癌、肝癌等其他腹部脏器疾病,最终实现 “一次CT,多癌筛查” 的宏伟目标。
当然,该研究也存在局限性,如其回溯性设计。未来需要大规模的前瞻性临床试验来进一步验证GRAPE在真实临床部署中的有效性和成本效益。
总而言之,GRAPE模型展示了AI技术如何挖掘常规医疗数据中的隐藏价值,解决临床痛点。它不仅为胃癌防治提供了新思路,也为AI驱动的预防医学开启了充满想象空间的新篇章。
推荐阅读
-
• 论文原文: AI-based large-scale screening of gastric cancer from noncontrast CT imaging:https://www.nature.com/articles/s41591-025-03785-6
(文:子非AI)